松浦稔
仲瀬裕志、松浦稔、竹内健、長沼誠、松岡克善、藤井俊光、福井寿朗、高津典孝
I.研究の目的・背景
01 | 目的
厚生労働科学研究 難治性疾患克服研究事業「難治性炎症性腸管障害に関する調査研究」(鈴木班)の全国多施設共同研究として、腸管型ベーチェット病(BD)におけるアダリムマブ(ADA)とステロイドの有効性および安全性を比較検討する。。
02 | 背景
腸管型ベーチェット病(BD)の原因は不明であり、未だ治療法は定まっていない。
ヒト型抗TNFα抗体製剤であるアダリムマブ:ADA(ヒュミラ®)はBDに対する有効性が認められ、日本において2013年5月に保険承認された1)。
しかしながら既存治療に対するADAをはじめとする生物学的製剤の位置付けは定まっておらず、ステロイドとの比較に関する前向きな検討も存在しない。BDは欧米諸国で少なく、日本・韓国・中国・中近東・東地中海沿岸といった地域に多い疾患であり、日本でも「現在腸管ベーチェット・単純性潰瘍コンセンサス・ステートメント」の作成・改定が行われている2)。BDの標準治療・治療方針における両薬剤の位置付けを定めるためにも、両薬剤の前向き比較試験を行う必要がある。
II. 対象患者
01 | 適格基準
既存治療※で効果不十分かつ回盲部に典型的な打ち抜き潰瘍を有する腸管型ベーチェット病の患者
※既存治療とは「5ASA製剤、栄養療法、ステロイド(2週間以内に10mg/day以下)、コルヒチン、タクロリムス、シクロスポリン、メトトレキサート、アザチオプリン、6メルカプトプリン、インフリキシマブ(投与2回までの不耐症状出現例)」のいずれか、とする
02 | 除外基準
- ベーチェット徴候を認めない単純性潰瘍の患者
- アダリムマブ使用禁忌の患者
- 重篤な感染症(敗血症等)の患者
- 活動性結核の患者
- 本剤の成分に対し過敏症の既往歴のある患者
- 脱髄疾患(多発性硬化症等)及びその既往歴のある患者
- うっ血性心不全の患者
- ステロイド剤使用禁忌の患者
- 本剤の成分に対し過敏症の既往歴のある患者
- 妊娠・授乳中の患者
- 15歳未満の患者
- 試験の同意が得られない患者
- 2週間以内に10mg/dayを超えるステロイドを投与した患者
- 2週間以上ステロイドを投与している患者
- アダリムマブやインフリキシマブの治療歴がある患者。但し、インフリキシマブ既投与例でも、投与2回目まで(0週と2週)に不耐症状を生じた症例であれば登録可能とする。
- 2週間以内に5ASA製剤、栄養療法、4週間以内にコルヒチン、タクロリムス、シクロスポリン、メトトレキサート、8週間以内にアザチオプリン、6メルカプトプリンの追加・増量を行った患者
- 悪性腫瘍の患者
- 非典型的な消化管病変(潰瘍性大腸炎類似のびまん性炎症やクローン病類似の縦走潰瘍ないし縦列する潰瘍)を伴う腸管型ベーチェット病の患者
- その他医師が不適当と判断した患者
III. 薬剤の概要
01 | アダリムマブ(ヒュミラ)
- 一般名:アダリムマブ
- 商品名:ヒュミラ皮下注40mgシリンジ0.8m
- 剤形:注射剤(プレフィルドシリンジ)
- 製造販売(輸入)元:アッヴィ合同会社
- 販売元:エーザイ株式会社
- 薬効分類:ヒト型抗ヒトTNFαモノクローナル抗体製剤
効能・効果:既存治療で効果不十分な腸管型ベーチェット病
用法・用量:通常、成人にはアダリムマブ(遺伝子組み換え)として初回に160mgを、初回投与2週間後に80mgを皮下注射する。初回投与4週間後以降は、40mgを2週に1回、皮下注射する。 - 警告:添付文書参照
- 禁忌:重篤な感染症(敗血症等)の患者
活動性結核の患者
本剤の成分に対し過敏症の既往歴のある患者
脱髄疾患(多発性硬化症等)及びその既往歴のある患者
うっ血性心不全の患者 - 副作用:関節リウマチ、尋常性乾癬、関節症性乾癬、強直性脊椎炎、若年性特発性関節炎、腸管型ベーチェット病、クローン病及び潰瘍性大腸炎の国内の臨床試験において、安全性評価対象1224例中1043例(85.2%)に副作用が認められ、その主なものは、鼻咽頭炎380例(31.0%)、注射部位紅斑125例(10.2%)、注射部位反応110例(9.0%)、発疹97例(7.9%)、上気道感染81例(6.6%)等であった。
- 臨床使用成績:既存治療(ステロイド又は免疫調節剤)で効果不十分な腸管型ベーチェット病患者を対象とした非盲検非対照試験における24週後の著明改善率(消化器症状の総合評価及び内視鏡所見改善度がいずれも1以下(著明改善、完全寛解)となった被験者の割合)は、45.0%(9/20例)を示した。
注) 厚生労働省ベーチェット病に関する調査研究班の診断基準による完全型、不全型又は疑いと診断され、回盲部に直径1cm以上の典型的潰瘍が認められた患者が対象とされた。 - その他:添付文書参照
02 | プレドニン(プレドニゾロン)
- 一般名:プレドニゾロン
- 商品名:プレドニン錠5mg
- 剤形:錠剤
- 製造販売元:シオノギ製薬株式会社、杏林製薬株式会社、武田薬品工業株式会社、東和薬品株式会社、コーアイセイ株式会社、株式会社陽進堂薬効分類:合成副腎皮質ホルモン剤
- 効能・効果:限局性腸炎、潰瘍性大腸炎、ベーチェット病皮膚病変(眼症状のない場合)、全身性血管炎、難治性口内炎・舌炎等
- 用法・用量:通常、成人にはプレドニゾロンとして1日5~60mg を1~4 回に分割経口投与する。なお、年齢、症状により適宜増減する。
- 警告:本剤を含むがん化学療法は,緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本療法が適切と判断される患者についてのみ実施すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
- 禁忌:本剤の成分に対し過敏症の既往歴のある患者
- 副作用:再評価結果における安全性評価対象例2299 例中、副作用は512例(22.27%)に認められた。主なものは,満月様顔貎が110 件等であった。
- 臨床使用成績:再評価結果における有効性評価対象例は2351 例であり、有効率は69.5%(1633 例)であった。
- その他:添付文書参照
IV. 試験方法
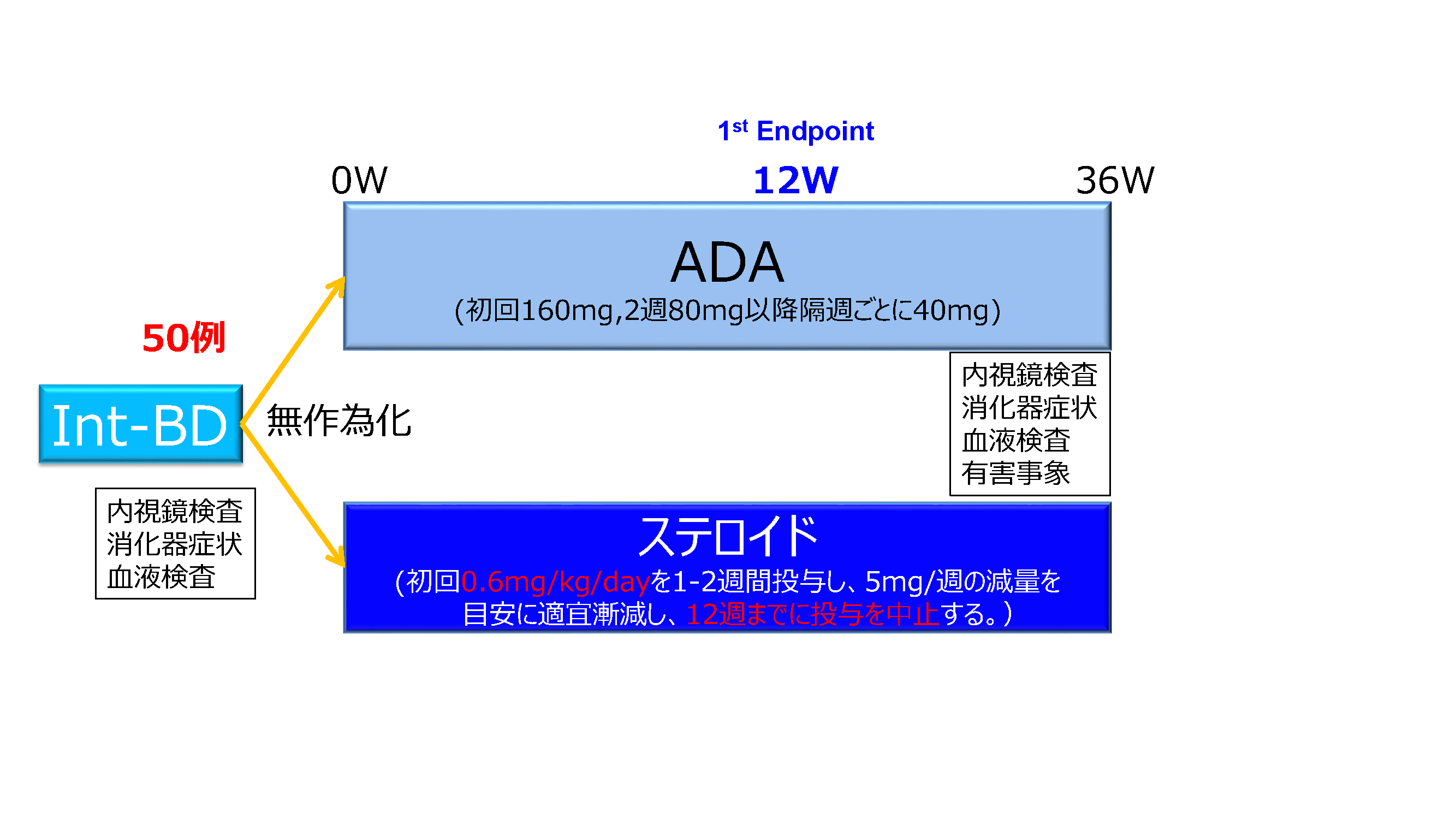
01 | 試験デザイン
薬剤投与法による分類:多施設共同プロスペクティブ無作為化比較試験(オープンラベル)
試験内容による分類:第Ⅳ相臨床試験
02 | 登録方式、割付方法
登録センター(大阪市立大学医学部附属病院 臨床研究・イノベーション推進センター)に症例登録を行うことにより、症例登録と無作為割り付けが行われる。割付け因子は免疫調節剤併用の有無とする。以降は割付時にデータセンターから付与される被験者識別コードで症例を管理する。
03 | 投与方法、投与量、投与期間
- アダリムマブ群
アダリムマブを初回160mg、2週後80mg、以後2週ごとに40mgを継続して投与する。
- ステロイド群
プレドニゾロンを初回0.6mg/kg/dayを1-2週間投与し、5mg/週の減量を目安に適宜漸減し、12週までに投与を中止する。
※両群とも12週までに効果不十分で他治療に主治医の判断で移行した場合は無効例と判定する。
04 | 実施の手順
- 択基準および除外基準を確認し、対象症例のスクリーニングを行う。
- 該当症例に口頭および文書により試験の説明を行い文書にて同意を得る。なお、患者が未成年の場合には本人に加え代諾者より同意の取得を行う。
- 登録センター(大阪市立大学医学部附属病院 臨床研究・イノベーション推進センター)に症例登録を行い無作為割付を受ける。
- 無作為割付結果に従い処方を行う。
- 各観察地点において調査項目の評価を行なう。
- 症例報告書(CRF)を記入・提出する(p12.「10.記録の作成方法、提出、保管、廃棄」参照)。
05 | 検査内容、検査スケジュール
患者背景
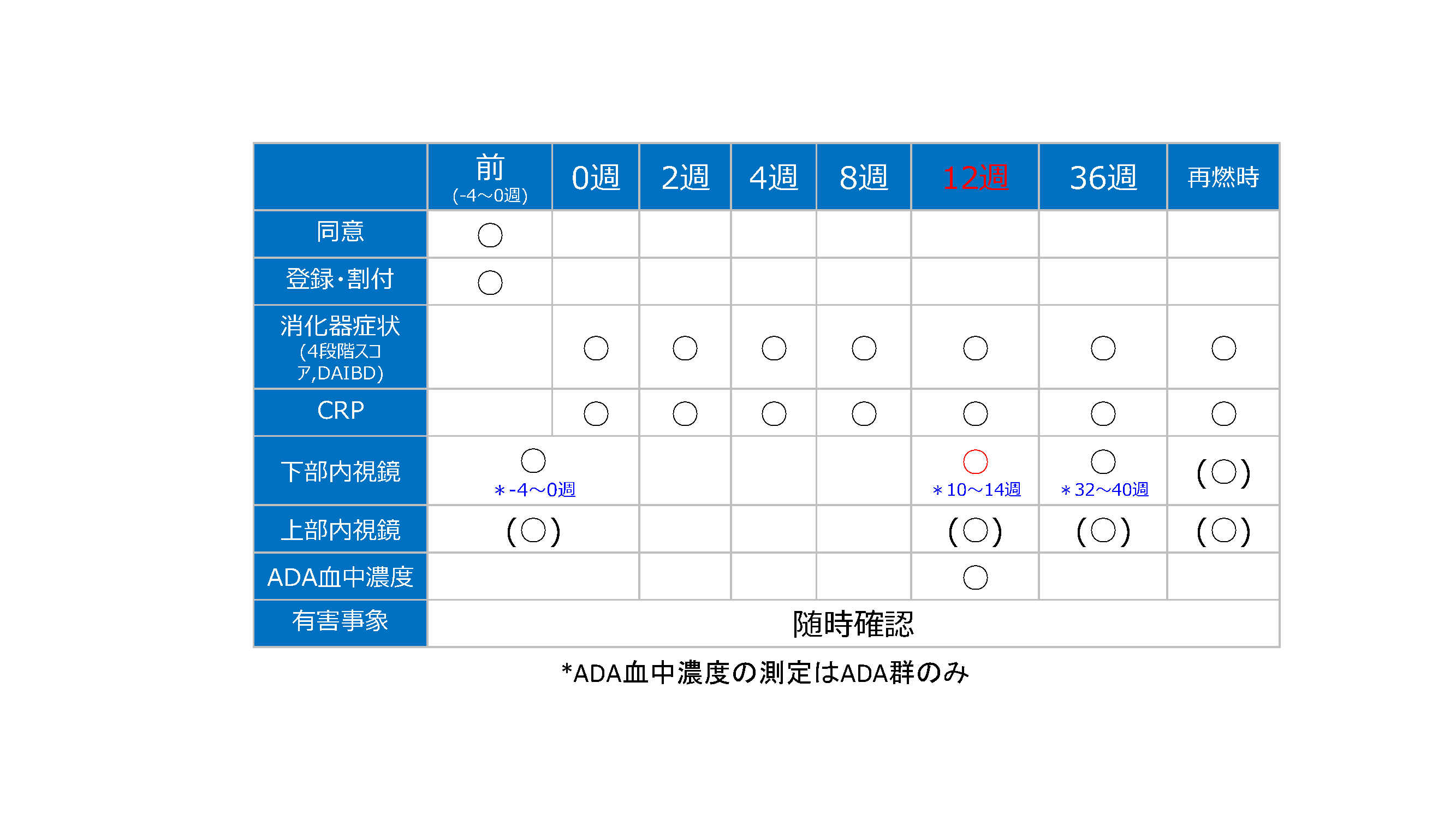
性別、年齢、身長、体重、併用薬、栄養療法の併用、罹病期間(診断からの期間)、ベーチェット症候の有無、食道や胃十二指腸病変の有無、合併症、喫煙等を調査する。内視鏡検査
0週、12週、36週、再燃時に下部消化管内視鏡検査を実施する。下部消化管内視鏡所見は内視鏡所見改善スコア(面積に対する指標と深さに対する指標:および両者を組み合わせた判定)1)*1により評価する。内視鏡写真を中央判定委員で評価するため回盲部のもっとも主要な潰瘍性病変の内視鏡画像を添付し提出する。できるだけ、潰瘍の長径が判定できる物(生検鉗子、メジャー鉗子、ゴム性円盤など)を含めて撮影した内視鏡画像も匿名化して研究事務局に提出する。こうした対比物が含まれていない内視鏡写真でも潰瘍全景が写っており、内視鏡中央判定委員会で潰瘍縮小率が判定可能な写真なら可とする。また、X線造影検査も潰瘍サイズが分かれば中央判定委員会の資料として用いることを認める。なお、内視鏡中央判定委員会で縮小率が判定困難な不適切写真と判定された場合、その症例は解析対象外とする。自覚症状
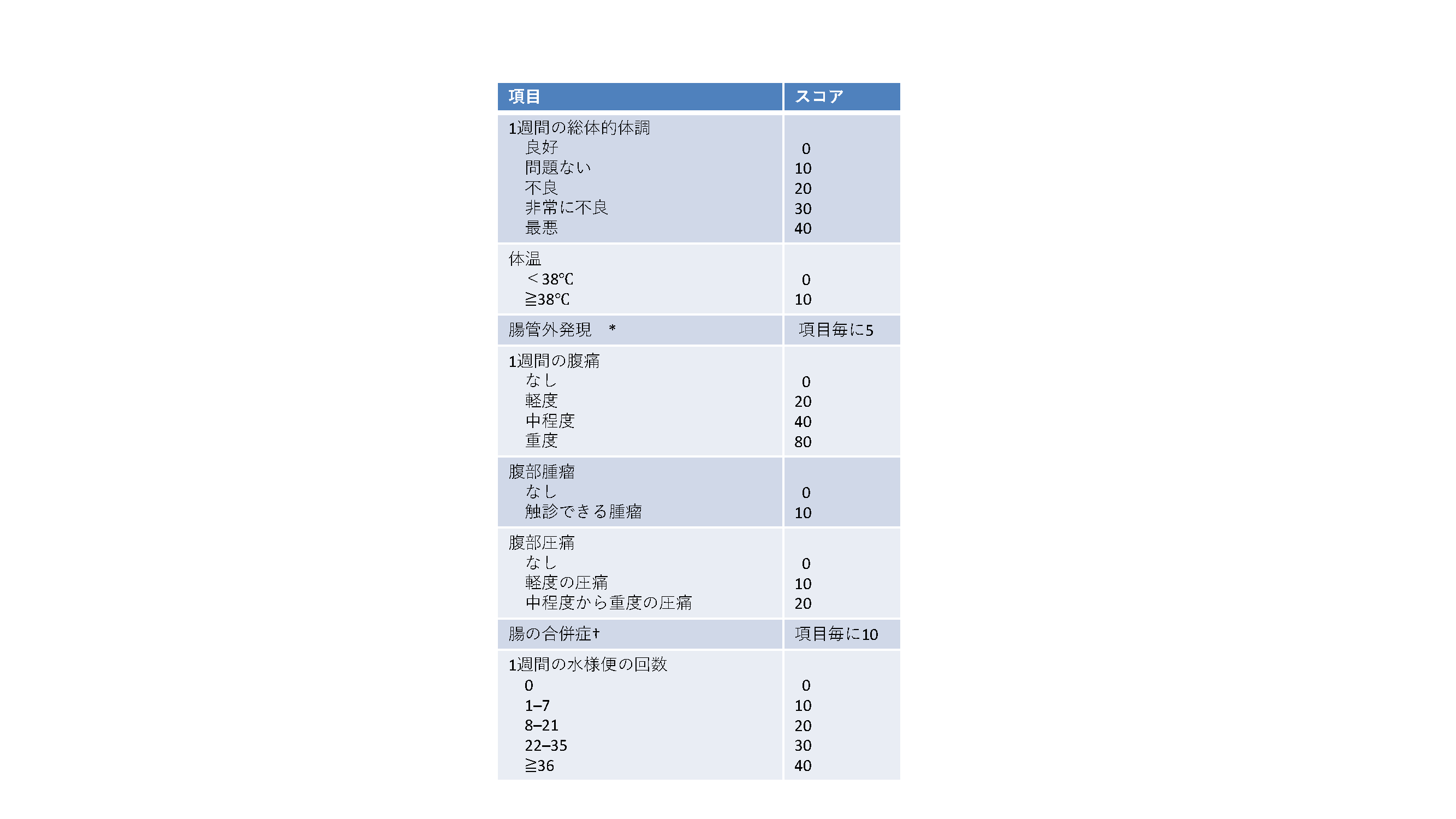
0週、2週、4週、8週、12週、36週、再燃時に消化器症状4段階スコア1)*1、DAIBD3)*2を測定する。血液検査
0週、2週、4週、8週、12週、36週、再燃時にCRPを測定する。なお、アダリムマブ群は12週後にはアダリムマブ血中濃度や抗アダリムマブ抗体(AAA:antibodies against adalimumab)の測定を行うため5mlの採血を行い遠心分離により2ml程度の血清を得て凍結後、兵庫医科大学 腸管病態解析学/ 炎症性腸疾患学内科部門へ送付する。保存した血清は検査会社等により一括して測定する。有害事象
試験期間中は随時副作用発現の有無を調査する。
06 | 中止・脱落基準
登録患者の中止
- 試験開始後、患者より中止の申し入れがあった場合
- 有害事象(副作用)発現のため、試験継続が困難と判断した場合
- 試験開始後、明らかな不適格例であることが判明した場合
- その他、研究医師が試験を中止すべきであると判断した場合
試験自体の中止
- 被験者のリクルートが困難で予定症例の半数以上を達成することが困難と判断された場合
- 予定症例数または予定期間に達する前に、(中間解析等により)試験の目的が達成された場合
- その他、研究医師が試験を中止すべきであると判断した場合
- 以上の場合には、研究参加施設の病院長、倫理委員会に報告する。
07 | 併用・支持療法
12週まで試験薬剤および試験の結果に影響を与える可能性のある5-ASA製剤,免疫調節剤,コルヒチン,成分栄養剤など併用薬剤の投与量は変更しない。12週までに併用薬剤の増量を要した症例は無効例と判定する。また12週以降36週までは併用薬剤の減量は可能とするが、増量した場合は36週での解析において無効例として扱う。
また無効例となった症例は、その後の治療内容とその効果についてもデータを集積する。
08 | 後治療
試験の終了および中止・脱落後は治療に特別な制限はなく、各々の担当医師の判断のもと適切な治療を行う。
09 | 予測される有害事象と緊急時の報告方法
有害事象の定義
有害事象とは、試験薬が投与された被験者に研究期間中に生じるあらゆる好ましくない、あるいは意図しない徴候(臨床検査値の異常変動を含む)、症状または病気のことであり、当該試験薬との因果関係の有無は問わない。重篤な有害事象とは、試験薬が投与された(投与量を問わず)際に生じるあらゆる医療上のできごとのうち、以下の事象を指す。- 死亡に至ったもの
- 生命を脅かすもの
- 入院または入院・加療期間の延長が必要となったもの
- 永続的または重大な機能不全に陥ったもの
- 先天異常を来したもの
- その他の重大な医学的事象
予測される有害事象
アダリムマブは比較的多く報告されている有害事象として感染症、注射部位反応が挙げられる。プレドニゾロンは満月様顔貎、感染症、骨粗鬆症などが挙げられる。その他詳細は添付文書を参照とする。有害事象の対応
有害事象が発生した際には患者に伝達すると共に保険診療にて速やかにしかるべき対処を行なう。研究責任医師は、試験薬投与開始後に発現した新たな有害事象について、その内容、重症度(軽度、中等度、重度)、発現日、消失日時、転帰ならびに試験薬との因果関係(関連なし、多分関連なし、多分関連あり、関連あり)を症例報告書に記入する。緊急時の報告方法
緊急を要する重篤な副作用に関しては、兵庫医科大学 腸管病態解析学/ 炎症性腸疾患学内科部門に電話(0798-45-6663)もしくはFAX(0798-45-6790)で報告を行うこととする。また、担当医師は症例報告書に記載するとともに、各医療機関のしかるべき部門・報告者に報告する。
10 | 評価項目及びその基準
主要評価項目
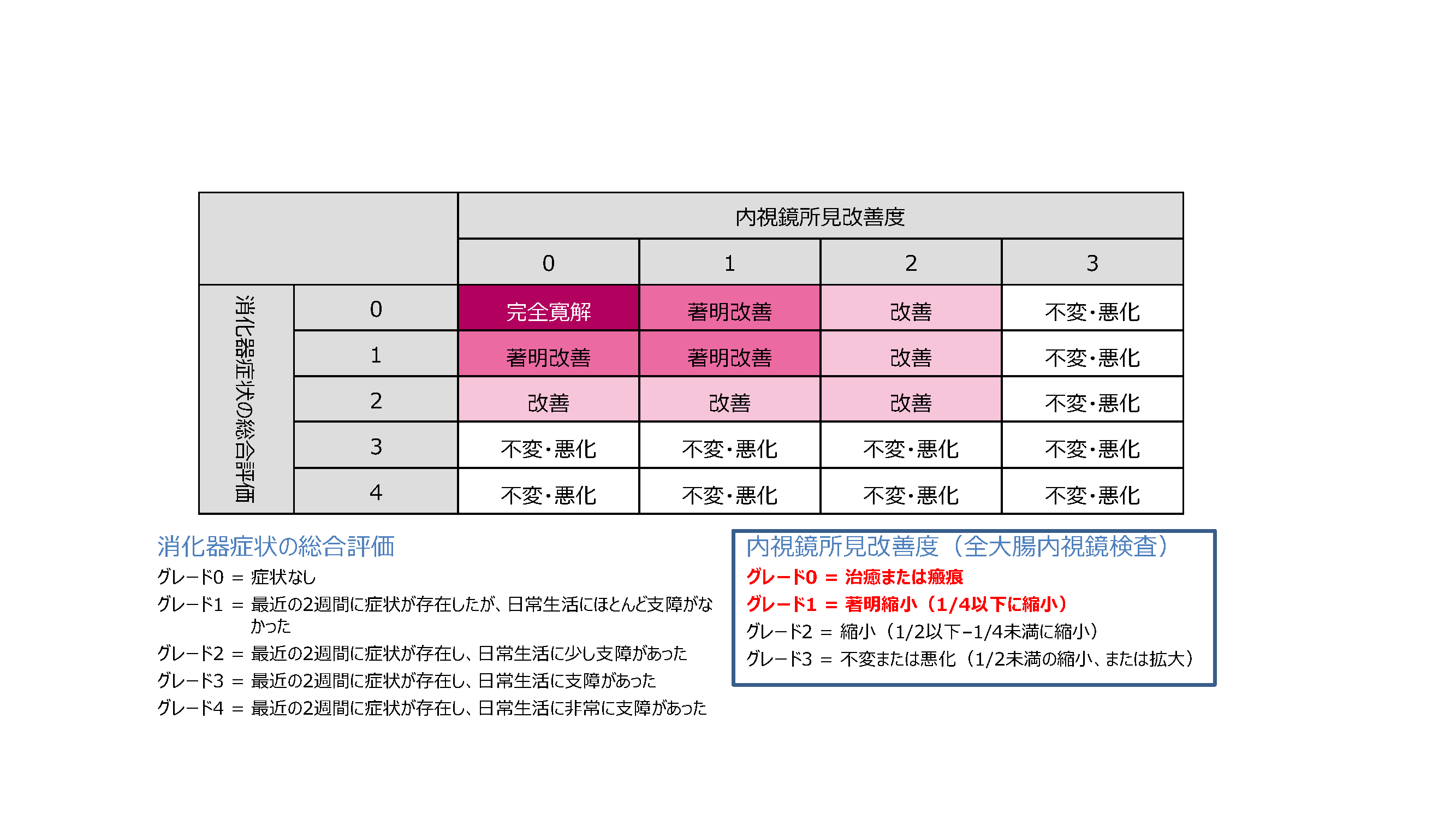
2週後の内視鏡的改善率(内視鏡所見改善スコア0または1)
*なお、回盲部の内視鏡写真を中央判定委員により評価する。副次評価項目
- 各観察期間における消化器症状の改善率、寛解率およびDAIBD、CRP
- 12週後、36週後の内視鏡所見改善率、粘膜治癒率
- ベーチェット症候の改善度
- 上部消化管病変の改善度
- 有害事象発生率
- 各治療不成功時の切り替え治療の有効性・安全性
- ADAの血中濃度と有効性の関連
- 36週以降、3年までの累積再燃率など長期経過成績など
各評価項目の定義
内視鏡的改善:内視鏡所見改善スコア0または1
消化器症状改善:消化器症状4段階スコアが0週時より低下し、0~2に至る
寛解:消化器症状4段階スコア0
粘膜治癒:内視鏡所見改善スコア0
完全寛解:寛解+粘膜治癒
11 | 解析方法
解析対象
無作為化が行われ、以降一度でも評価が可能であった患者を有効性と安全性の解析対象とする。なお、36週までの再燃、手術、アダリムマブないしプレドニゾロンの投薬中止は脱落例として扱う。統計解析
適宜下記の手法等により統計解析を行う 分割表分析:Chi-square test、Fisher’s exact test
対応のない2群の比較:対応のないt検定、Mann-Whitney U test
対応のある2群の比較:対応のあるt検定、Wilcoxon sign rank test
多変量解析:Logistic Regression Analysis
など解析責任者
大阪市立大学大学院医学研究科 公衆衛生学 福島若葉(教授)、大藤さとこ(講師)解析結果の評価
解析結果は内視鏡中央判定委員会とプロトコール委員会にて評価した後、公表を行う。
12 | 研究予定期間
症例集積期間:承認後 ~ 2022年12月31日(西暦)
症例追跡期間:承認後 ~ 2025年12月31日(西暦)
13 | 研究予定症例数とその設定根拠
研究予定症例数
50例(各群25例の2群間比較)設定根拠
アダリムマブ群を国内治験の成績を参考に55%と設定し、参考データがないステロイド群がこれを大きく下回り15%であった場合を想定すると有意差が認められるのに各群23例が必要となる(*いずれも検出力80%、αエラー5%で算出)。実施可能な症例脱落例を含め検討し各群25例に設定した。
14 | 症例記録・薬剤・用具の保管場所及び責任者
症例報告書(CRF): (保管場所)兵庫医科大学 腸管病態解析学/ 炎症性腸疾患学内科部門医局および大阪市立大学医学部附属病院 臨床研究・イノベーション推進センター
(保管責任者)渡辺憲治
(保管方法)個人情報が含まれないことを確認した上で管理する。
薬剤:(保管場所)保険診療で行われるため、各医療機関の処方箋により各々患者は薬剤部、調剤薬局から供給をうける
(保管責任者)各医療機関の薬剤部または調剤薬局
01 | 研究責任者・実施分担者
研究責任者
兵庫医科大学 腸管病態解析学/ 炎症性腸疾患学 内科部門 特任准教授 渡辺憲治
(大阪市立大学大学院医学研究科 消化器内科学 客員准教授 渡辺憲治)
住所:兵庫県西宮市武庫川町1番1号
Mail:ke-watanabe@hyo-med.ac.jp
電話:0798-45-6663
FAX: 0798-45-6790施設内の実施分担者
兵庫医科大学 炎症性腸疾患学 内科部門 教授 中村志郎, 准教授 樋田信幸, 講師 宮嵜孝子, 助教 横山陽子, 助教 上小鶴孝二, 助教 河合幹夫, 特任助教(腸管病態解析学)高川哲也, 特任助教(腸管病態解析学)佐藤寿行, 炎症性腸疾患内科 病院助手 藤本晃士, 病院助手 小柴良司, 病院助手 小島健太郎, 炎症性腸疾患学内科部門 実験補助 長瀬和子(2018年8月14日現在)共同研究機関および責任医師(2018年8月14日現在:順不同)
東京医科歯科大学 消化器内科 渡辺守 北里大学北里研究所病院 炎症性腸疾患先進治療センター 日比紀文
プロトコール委員
兵庫医科大学 腸管病態解析学/ 炎症性腸疾患学 内科部門 渡辺憲治
岩手医科大学内科学講座 消化器内科消化管分野 松本主之
杏林大学医学部 消化器内科学 久松理一
札幌医科大学 消化器内科学講座 仲瀬裕志
北里大学 新世紀医療開発センター 小林清典
福岡大学医学部 消化器内科学講座 平井郁仁
研究参加施設 (2019年7月26日現在)
琉球大学光学医療診療部、金沢大学消化器内科、愛知医科大学消化器内科、関西医科大学内科学第三講座(消化器肝臓内科)、広島大学内視鏡診療科、東北大学消化器内科、山梨大学第1内科・光学医療診療部、大分赤十字病院消化器内科、兵庫医科大学炎症性腸疾患学講座内科部門、弘前大学消化器血液内科学、新潟大学消化器内科、杏林大学第三内科、旭川医科大学消化器血液腫瘍制御内科学、名古屋市立大学消化器内科、松山赤十字病院胃腸センター、滋賀医科大学消化器内科、自治医科大学附属さいたま医療センター消化器科、防衛医科大学消化器内科、東京女子医科大学消化器病センター、慶應義塾大学消化器内科、 東近江総合医療センター消化器内科、諏訪赤十字病院腫瘍内科、香川県立中央病院消化器内科、聖マリアンナ医科大学消化器肝臓内科、金沢医療センター消化器科、北里大学北里研究所病院炎症性腸疾患先進治療センター、東邦大学医療センター佐倉病院 消化器内科、札幌医科大学 消化器内科学、北里大学医学部 消化器内科、福岡大学筑紫病院 消化器内科、岩手医科大学内科学講座 消化器内科消化管分野、東京医科歯科大学 消化器内科、横浜市立大学附属市民総合医療センター 炎症性腸疾患センター、大阪市立大学 消化器内科、大阪市立総合医療センター 消化器内科、京都大学医学部附属病院 消化器内科、社会医療法人 浦添総合病院 消化器内科、札幌厚生病院 消化器内科(IBDセンター)、東京慈恵医科大学 消化器・肝臓内科、千葉大学消化器内科、石田消化器IBDクリニック、大阪赤十字病院消化器内科、産業医科大学医学部第1内科学講座、横浜市立大学大学院医学研究科眼科学講座、横浜市立大学大学院医学研究科幹細胞免疫制御内科学 血液・リウマチ・感染症内科、横浜市立大学大学院医学研究科肝胆膵消化器病学、辻仲病院柏の葉 消化器内科・IBDセンター内視鏡中央判定委員
横浜市立大学附属市民総合医療センター 炎症性腸疾患センター 国崎玲子
東京医科歯科大学 消化器内科 長堀正和
辻仲病院柏の葉 消化器内科・IBDセンター 竹内 健モニタリング委員
大船中央病院 特別顧問 上野文昭データセンター(症例登録・CRF送付先)
大阪市立大学医学部附属病院 臨床研究・イノベーション推進センター
〒545-0051
大阪市阿倍野区旭町1-2-7 あべのメディックス6F
大阪市立大学医学部附属病院 臨床研究・イノベーション推進センター
電話:06-6645-3443
FAX:06-6646-3588
16 | 臨床試験情報の登録・公開
当試験はUMINに事前登録している(UMIN000012469)。
17 | Authorship
論文化の際の著者順は登録症例数を考慮してプロトコール委員会で決定する。
15.(3)と(4)に記載された医師、および統計解析担当者(2名まで)は共著者とする。
V. 研究における医学倫理的配慮について
01 | 個人情報の保護
試験実施に係る生データ類および同意書等を取扱う際は、被験者の秘密保護に十分配慮する。病院外に提出する症例報告書等では、被験者識別コード等を用いて行う。試験の結果を公表する際は、被験者を特定できる情報を含まないようにし、試験の目的以外に試験で得られた被験者のデータを使用しない。
02 | 研究の安全性に対する配慮の方法
本試験では、承認された用法・用量以下の量で、薬剤が投与され、患者は通常診療における投薬、問診、内視鏡検査、採血が行われる。健康被害が発生した場合においては直ちに適切な医療処置を行い対処する。
03 | 被験者に説明し同意を得る書類・方法
治験等審査委員会で承認の得られた同意説明文書を渡し、口頭および文書により十分な説明を行い、文書にて同意を得る。なお、当試験への参加が任意であること、参加に同意しない場合でも不利益を受けないこと、当試験で得た同意について、いつでも不利益を受けることなく撤回する権利を有することを説明文書に記載の上保証する。患者が未成年の場合には本人に加え代諾者より同意の取得を行う。
04 | 研究対象となる個人の人権の擁護方法
本臨床研究はヘルシンキ宣言(世界医師会)および臨床研究に関する倫理指針(厚生労働省)を遵守して施行される。担当医師は、本試験の実施にあたっては倫理的な配慮を慎重にし、試験内容について十分説明した上で、本申請書に添付する文書で、患者本人の同意を得る。研究に参加するか否かは、被験者本人の自由意思により決定され、同意後であっても、被験者本人の意思によりいつでも中止が可能である。また、参加中止に伴う不利益は受けない。本研究で知り得た情報は、個人が同定できる形ではいかなる状況においても公表せず、かつ厳重な管理下で保管される。また、本人が希望すれば、本人の情報は本人にのみ文書にて報告する。
05 | 試験の費用負担
この試験は通常診療の範囲内である。したがって通常の診療と同様に患者の健康保険を使用し、一部自己負担が発生する。血液検査の中で保険適応外であるアダリムマブの血中濃度・抗体測定に関する費用(送付時の郵送費・検査キットも含む)は兵庫医科大学 腸管病態解析学/ 炎症性腸疾患学内科部門の研究費及び日本消化管学会の多施設共同研究助成(H29年度)助成金より支払われ、患者の費用負担が増えることはない。なお、患者への特別な謝礼も行なわない。
06 | 健康被害に対する補償
当試験は通常診療の範囲であり、有害事象が発生した場合においては保険診療に従い直ちに適切な医療処置を行い対処する。アダリムマブ、プレドニゾロンは保険診療で使用しているため、死亡または障害が発生した場合には医薬品医療機器総合機構の医薬品副作用被害救済制度の対象となる場合もある。なお、当試験においては別途臨床研究保険へ加入している。
07 | 研究成果の帰属と結果の公表
本試験の研究成果は参加施設に帰属する。参加施設で協議し試験終了後には速やかにデータ解析を行い学会発表および学術誌への論文投稿を行う。
08 | 研究者の利益相反状態についての申告
当試験の実施において特別な資金の提供を受けておらず、試験の計画、実施、報告において試験の結果および結果の解釈に影響を及ぼすような利益相反は存在しない。本研究は兵庫医科大学 腸管病態解析学/ 炎症性腸疾患学内科部門の研究費及び日本消化管学会の多施設共同研究助成(H29年度)助成金の研究費にて運営される。
施設内の本研究の研究責任者および実施分担者における利益相反状態については、兵庫医科大学利益相反委員会の審査結果に基づき、必要な措置を講じた上で研究を実施する。
09 | 倫理委員会の承認
本研究は兵庫医科大学倫理審査委員会の承認を得て実施する。
また、共同研究機関においては各々の施設の取り決めに従い倫理委員会の承認を得て実施する。
10 | 研究事務局
- 作成:記録の媒体:症例報告書(CRF)
作成する時期:症例の観察期間終了後
作成する研究者等の名前:各施設の研究責任者及び分担者 - 提出:各参加施設は症例報告書(CRF)をデータセンター(大阪市立大学医学部附属病院 臨床研究・イノベーション推進センター)に送付する。匿名化した内視鏡写真、血清検体(アダリムマブ群:アダリムマブ血中濃度, 抗アダリムマブ抗体測定用)は研究責任者に送付する。記録・試料を送付する際は「様式1)他の研究機関への試料・情報の提供に関する記録」を作成し添付する。
- 保管:研究責任者が各参加施設から送付された症例報告書(CRF)、他の研究機関への試料・情報の提供に関する記録を保管することで、各参加施設における記録の保管の義務を代行する。ただし各参加施設の責任者は取得した同意文書、被験者識別コードと患者との対応表を研究終了後原則5年間保管する(ただし各施設の規定に従う)。研究責任者は兵庫医科大学の規定に従い、試料・記録類を適切に保管する。具体的には、記録類は可能な限り電子化し研究責任者が責任をもってハードティスク等の記憶媒体で当該研究の結果の公表から10年間保管し、保管期間終了後は、個人を識別できる情報を取り除いた上で廃棄(消去)する。血清検体は検査会社等により一括して測定するまで兵庫医科大学 腸管病態解析学/ 炎症性腸疾患学内科部門のフリーザーで保管する。検査項目測定後、残余検体が生じた場合は、研究責任者に返却され、研究責任者の責任の下5年間保管する。
- 廃棄:本研究において得られた記録・試料を廃棄する際は、匿名化したまま個人情報が含まれていないか確認した上で廃棄する。
11 | 予測される医学上の貢献
BDに対するADAとステロイドの有効性・安全性の比較結果が明らかになれば、適切な治療方針、薬剤選択の構築に繋がる。BDは欧米諸国で少なく、日本・韓国・中国・中近東・東地中海沿岸といった地域に多い疾患であり、日本から世界に向けてエビデンスを発信することが求められている。
VI. 文献
アダリムマブ審査報告書http://www.info.pmda.go.jp/approvalSrch/PharmacySrchInit?
腸管ベーチェット・単純性潰瘍コンセンサス・ステートメント改訂ワーキンググループ(研究分担者 久松理一) 厚生労働科学研究費補助金特定疾患対策研究 原因不明小腸潰瘍症の実態把握、疾患概念、疫学、治療体系の確立に関する研究 分担研究報告書
Lee JH et al. Efficacy of Infliximab in Intestinal Behc¸et’s Disease: A Korean Multicenter Retrospective Study. Inflamm Bowel Dis 2013;19: 1833-1838.
インフォメーション
- 2020.04.09チーム情報を公開しました

