松浦稔
仲瀬裕志、松浦稔、竹内健、長沼誠、松岡克善、藤井俊光、福井寿朗、高津典孝
I.研究の目的・背景
01 | 目的
本研究は、クローン病(Crohn’s disease:CD)の画像診断法として、欧米が主張するconventional ileocolonoscopy(ICS:経肛門的に直腸から回腸終末部までを内視鏡観察)とMR enterography (MRE)の組合せか、本邦で開発されたバルーン小腸内視鏡(balloon assisted enteroscopy: BAE、経肛門的に直腸から挿入し、回腸終末部を越えて、可及的により口側に挿入して内視鏡観察)とMREの組合せを比較検討し、欧米のstrategyの妥当性や至適なクローン病画像診断法、またクローン病新内視鏡スコアの開発に寄与することを目的とする。ICSは観察範囲が短いため検査時間が短く、被験者への侵襲もBAEよりは少ないとされている。一方BAEは観察範囲が長いため検査時間は長くなるが、ICSで観察できない口側の小腸まで内視鏡観察が可能である。厚生労働省難治性炎症性腸管障害班会議(班長:鈴木康夫 東邦大学医療センター佐倉病院IBDセンター センター長)のプロジェクト研究の一環として行われる多施設共同前向きランダム化比較試験で、内視鏡医学研究振興財団の多施設共同研究助成金による補助を受けて行われる。
02 | 背景
CD小腸病変の画像診断は、本邦では小腸造影を中心に行われてきた。一方、欧米では近年、放射線被曝のリスクも考慮して、MREが主体となっており、各種のガイドラインやコンセンサスにも記載されている1)。我々のStudy Groupで行った前相feasibility studyによるpreliminaryな検討では、BAE経肛門的挿入例の約35%が狭窄や癒着により回腸下部までの挿入に留まり、MREでは前処置液の大腸流出による小腸拡張不良や撮影時の回腸位置移動によるBAEとの対比困難が課題として明らかになった。前相を受けて行う本研究は、BAEが開発された本邦から欧米が主張するICS+MREの妥当性を検証し、より適切なCD画像診断strategyの提供や、臨床現場で用い易い新内視鏡スコアの開発を目的としている。
・予測される医学上の貢献
本研究によって、欧米が主張するICSとMREによる検査法の妥当性や、ICSよりもBAEを施行すべき患者像が明らかにされ、今後の本法および世界の、CD小腸病変に対する画像診断方針の適正化に寄与する。
II.対象患者
01 | 適格基準
小腸造影や内視鏡、CT、MRI、超音波検査などにより小腸病変を有すると診断されたクローン病患者
02 | 除外基準
- 15歳未満の患者
- 大腸・小腸術後の患者
- ストマを有する患者
- バルーン内視鏡経肛門的挿入で回腸中部未到達の患者
- 内視鏡が通過できない高度な肛門病変や肛門狭窄、大腸狭窄を有する患者
- 閉所恐怖症の患者
- 心臓ペースメーカーを埋め込まれている患者
- MRIが禁忌となる金属を体内に有する患者
- 刺青を有する患者
- 妊娠中もしくは妊娠の可能性のある患者
- ガドリニウム(Gd)造影剤に過敏症の既往歴のある患者
- 気管支喘息のある患者
- 重篤な腎障害を有する患者
- イレウス症状を有する患者
- 責任医師および担当医師が不適と判断した患者
III.医療技術の概要
01 | 当該技術の方法
MR enterography:研究参加施設の1.5テスラーないし3テスラーのMRI機器を用い、別記の統一した撮影プロトコールを用いて行う。小腸の拡張を得るために大腸内視鏡検査に用いる前処置薬を投与する。前処置薬はポリエチレングリコール液ないしクエン酸マグネシウム等張液を用い(モビプレップ®配合内用剤は不可)、800cc以上の前処置薬を1時間以内で内服するものとする。なお、内視鏡検査の前処置を兼ねてもよいものとする。
バルーン小腸内視鏡:下記の内視鏡機器のいずれかを用いて、経肛門的挿入で挿入時間1時間以内を目安に可及的に小腸深部まで挿入する。できるだけ回腸中部までの挿入を目標とし、回腸中部まで到達していれば、挿入時間1時間に到達していなくても深部挿入を終了しても良いこととする。また、活動性の高い潰瘍性病変など深部挿入にリスクを伴う所見を認めた場合は、内視鏡医の判断で以深の内視鏡挿入を中止して良いこととする。 内視鏡挿入は全例CO2送気で行い、挿入時から動画撮影も行う。検査前に大腸内視鏡検査に準じた前処置を行い、適宜、患者苦痛を軽減するため前投薬を併用する。
ダブルバルーン小腸内視鏡: EN-580T、EN-450T5。富士フイルム社製 ※EN-450P5は使用不可とする。 シングルバルーン小腸内視鏡:SIF-Q260。オリンパス社製
conventional ileocolonoscopy:回腸終末部までの観察を目指し、経肛門的に挿入する。内視鏡が通過困難な狭窄や、穿孔のリスクがある病変を認めた際には、日常臨床と同様に内視鏡医が適切に判断する。なお、オリンパス社製PCF-PQ260(I/L)の使用は不可とする。
なお直腸肛門部から回腸終末部までの狭窄に対して内視鏡的バルーン拡張術を施行する症例もエントリー可とするが、検査時間のデータにおいては、内視鏡的バルーン術に要した時間を除いて用いることとする。また、バルーン小腸内視鏡ではガストログラフィン(バリウムは不可)を用いての選択造影は可とし、その所見もスコア化に用いることとする。(conventional ileocolonoscopyではガストログラフィンの選択造影は不可)
02 | 効果・安全性
MR enterography:使用するMRI機器や前処置薬は本邦で保険承認されたものであり、造影MRIや前処置薬の禁忌を順守して検査を行えば、安全性には問題がない。
バルーン小腸内視鏡:使用する内視鏡機器、前処置薬、前投薬の薬剤は本邦で保険承認されたものであり、検査中に血圧や脈拍、酸素飽和度をモニタリングしつつ検査するため、安全性は通常の保険診療で行われる検査と同等である。
03 | 他施設・他国での使用状況
MR enterography、バルーン内視鏡とも国内外で広く使用されている。バルーン小腸内視鏡:本邦で開発され、国内に広く普及している
IV. 試験方法
01 | 試験デザイン
検査法による分類:多施設共同前向き無作為化非盲検比較試験
試験内容による分類:第III相臨床試験
02 | 登録方式、割付方法
各施設で倫理委員会にて承認を得た後、患者に十分な説明と同意を得て、行う。
検査で得た、MRI画像、内視鏡画像(動画を含む)は、匿名化され、必要に応じて所見の中央判定にも用いられる。なお、中央判定は個人情報を消去した画像データを、各プロトコール委員が閲覧し、所見シートに記載する形で施行される。
同意を得た患者は、MREとBAE、両方の検査施行前に、メビックス株式会社のWEBランダム化システムにて、CRP (0.3mg/dl未満、0.3mg/dl以上)を割付け因子として、最小化法による動的割付けにより、ICS+MRE群とBAE+MRE群に無作為に割り付けされる。以降は割付時にデータセンターから付与される被験者識別コードで症例を管理する。被検者には、割り付け結果に応じた検査が施行される。
03 | 投与方法、投与量、投与期間
前処置薬や前投薬は、年齢、基礎疾患、排便状況などを考慮し、適宜、適切に投与する。
04 | 投与時期、投与量、投与期間の変更
前処置薬投与によるイレウス、内視鏡検査による消化管穿孔などが生じた場合には検査を中止し、適切な対応を行う。
05 | 検査内容、検査スケジュール
MR enterographyとバルーン小腸内視鏡/conventional ileocolonoscopyの間隔は1週間以内とし、同日でも可とする。
- 1.MR enterographyは下記の撮像手順とシーケンスで施行される。
なお、下記以外の撮影法も各施設で独自に追加して良いが、そのデータは本研究には用いない。
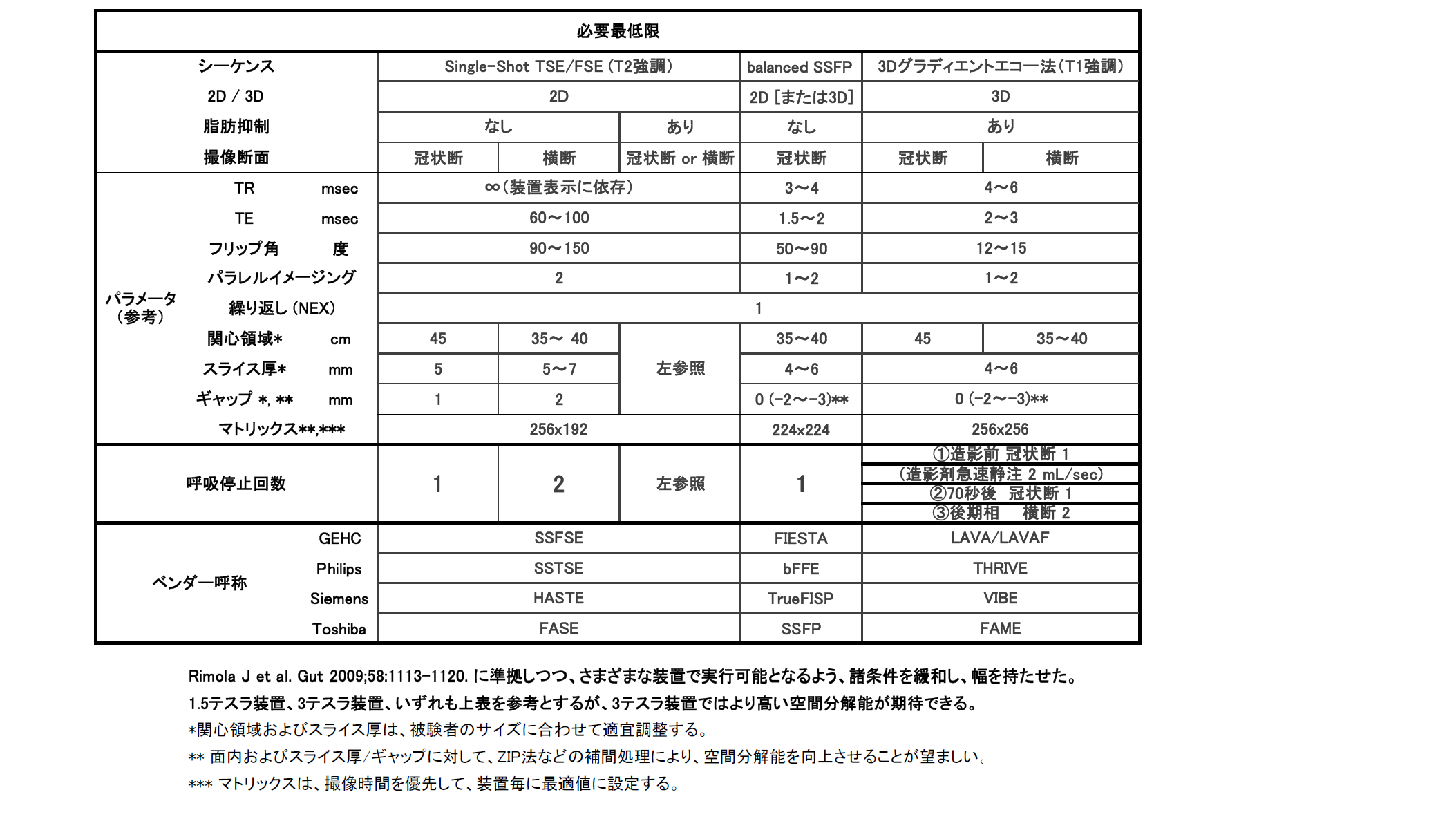
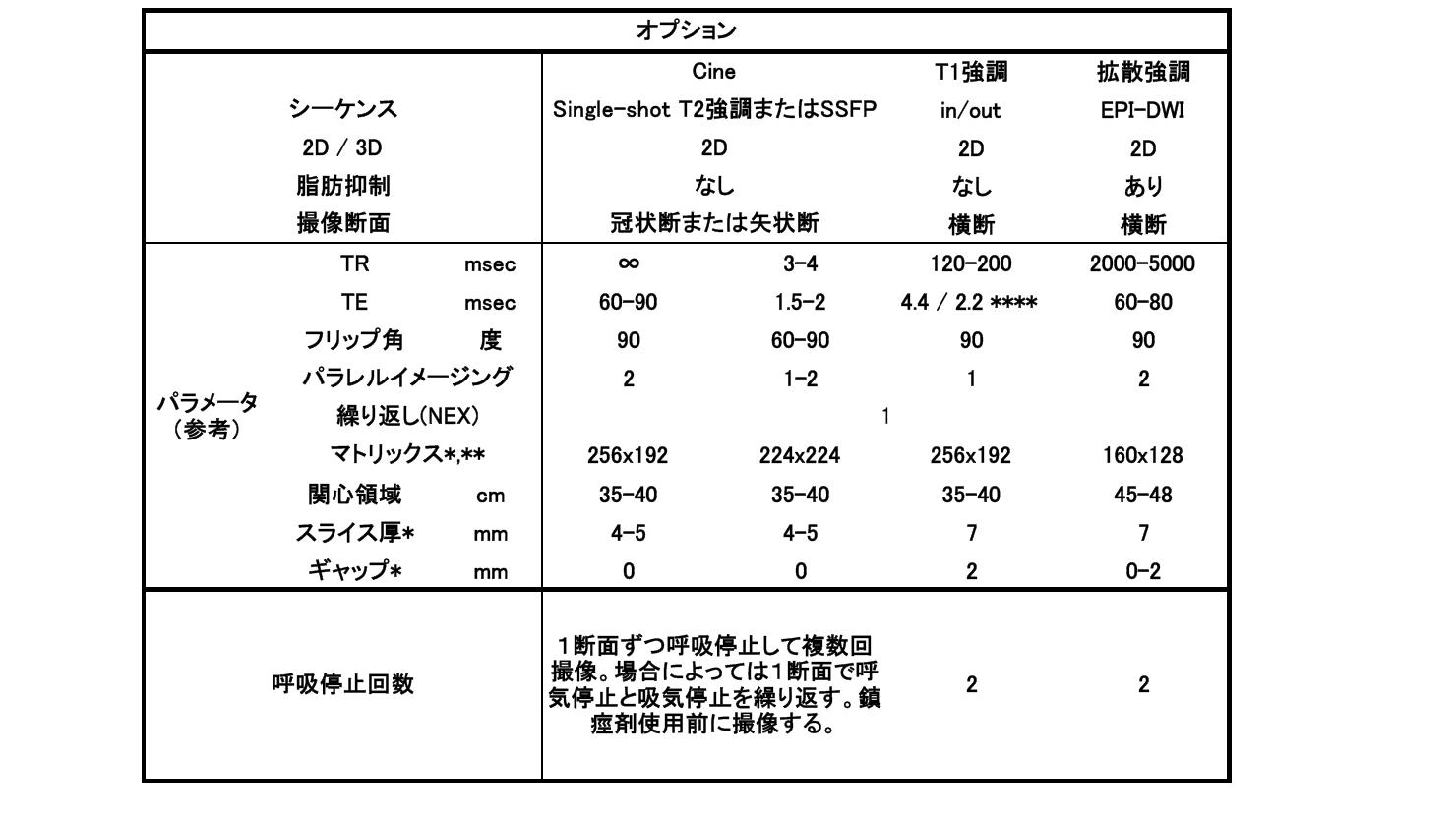
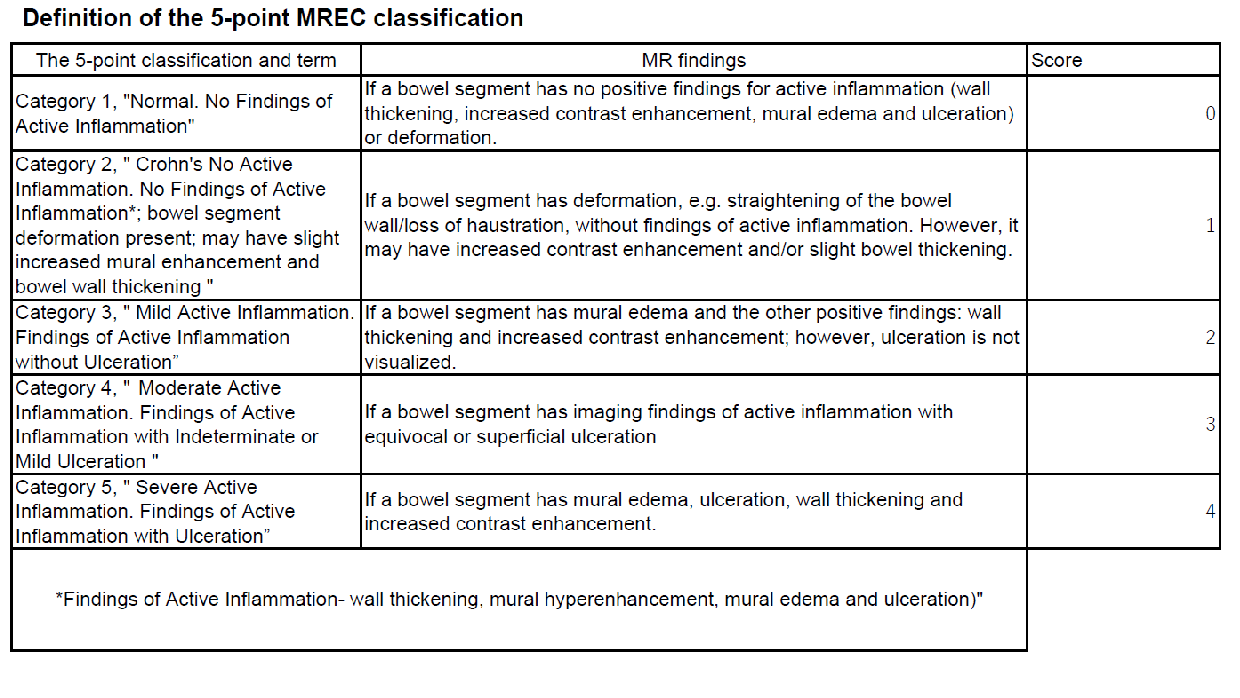
得られたMRE画像は下記のクローン病のMRE所見(Magnetic Resonance Index of Activity:MaRIA)スコア、東京医科歯科大学スコアを用いてスコア化される。
- 2.バルーン内視鏡は全例動画撮影され、下記のスコア化や中央判定に用いられる。
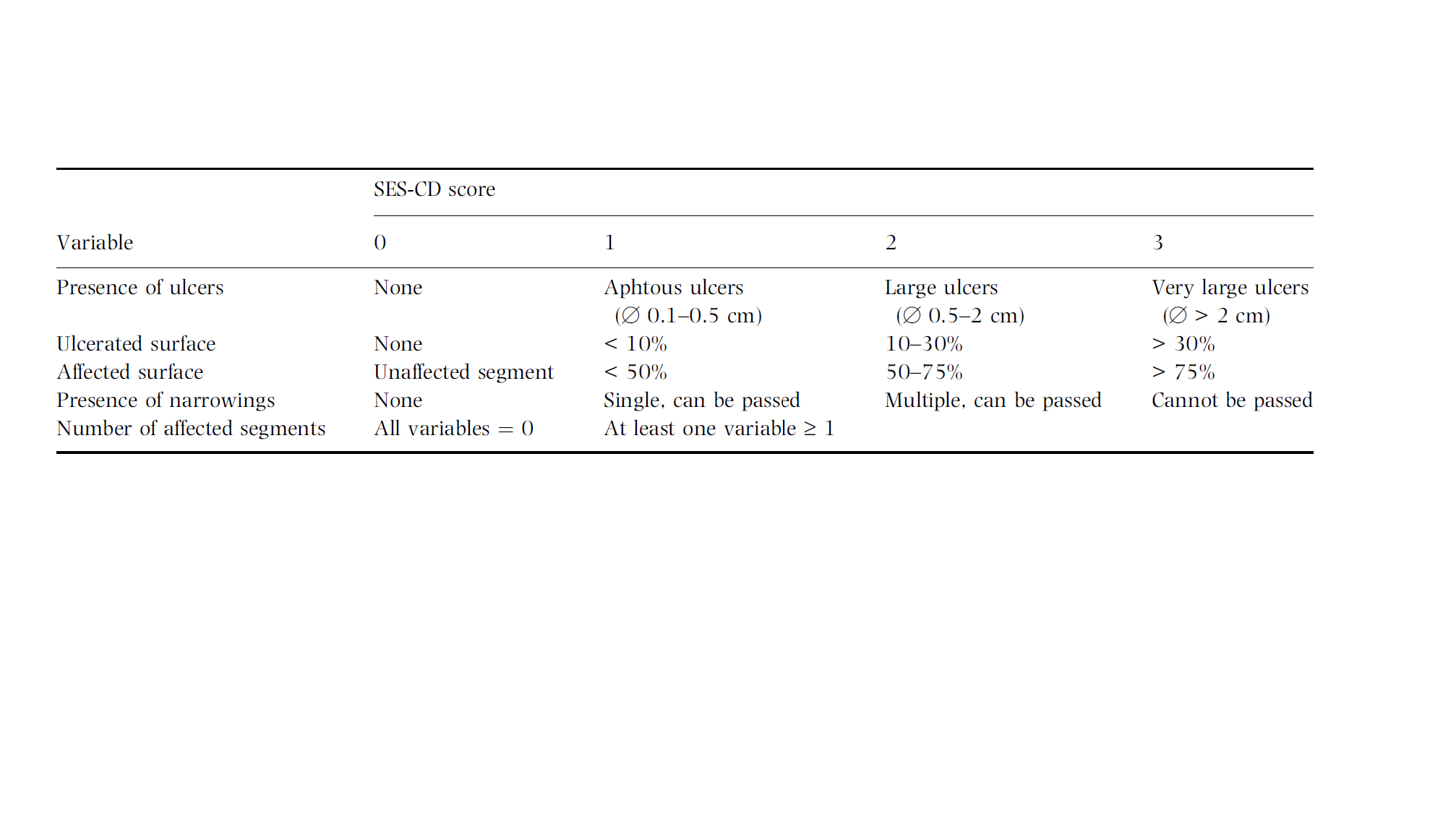
MREとBAEの対比評価部位は、回腸終末部、回腸下部~中部、回腸中部~上部、空腸の4部位とする。大腸はCD内視鏡スコア(Simple Endoscopic Score for Crohn Disease:SES-CDと新内視鏡スコア)のみ集積する。新内視鏡スコアはSES-CDと対比するため、回腸終末部、盲腸から上行結腸、横行結腸、下行結腸からS状結腸、直腸の5部位でスコア化し、最も病勢が進んでいる部位を明記する。スコア化にあたっては、選択造影の情報を付加しない場合と付加した場合の両方のスコア化したデータを集積する。
MREおよびBAE所見は専用アトラス(MRE、BAE両方)に基づいて主治医がスコア化したデータを解析に用いるが、それを補完する形で内視鏡動画等も含めた中央判定も行われる場合がある。
その他、本研究では以下の項目を調査表(CRF)にて調査する。
ランダム化割付け結果、内視鏡検査施行日、MRE検査施行日、年齢、性別、発症年、罹病期間、病型、肛門病変、腹部手術歴と術式、Montreal分類、合併症、既往歴、治療内容(5-アミノサリチル酸、成分栄養療法、ステロイド、血球成分吸着除去療法、6メルカプトプリン、アザチオプリン、インフリキシマブ、アダリムマブ、ウステキヌマブ)、CDの活動性指数(Harvey-Bradshaw Index: HBI)、血液検査データ(CRP、アルブミン、ヘモグロビン、白血球数、血小板数、血沈1時間値)、糞便検体の採取日と提出日、便カルプロテクチン値測定結果、便ヘモグロビン値、小腸4評価部位と大腸3部位(右側結腸、横行結腸、左側結腸)の腸管拡張の程度、前処置薬名、前処置薬内服量、前処置薬内服開始からMRE撮影開始までの時間、使用MRE機器名、MRE時鎮痙剤使用の有無と薬剤名、使用内視鏡機器名、前投薬鎮静鎮痙薬剤名、CO2送気の有無、内視鏡到達部位、到達範囲内狭窄の有無、内視鏡動画撮影の有無、選択造影施行の有無、内視鏡的バルーン拡張術施行の有無、有害事象のデータも集積される。
便中カルプロテクチン(サーモフィッシャーダイアグノスティックス株式会社)は、内視鏡前処置薬で出た便の検体は不可とし、内視鏡検査前3日以内に出た便を原則用いるものとする。
06 | 中止・脱落基準
- MREにおいて前処置薬が嘔気、嘔吐等で内服不十分だった患者
- バルーン小腸内視鏡(経肛門的挿入)において回盲弁より30cm程度挿入できなかった患者
中間解析で(主要)評価項目で有意差を認めれば、プロトコール委員の協議により、症例登録を終了する可能性がある。
また、以下のいずれかに該当した場合には研究責任者等は当該被験者の研究を中止する。
- 被験者より研究への参加継続の拒否、同意撤回の申し出があった場合
- 有害事象の発現を認め、研究責任者等が研究の継続を困難と判断した場合
- 被験者が対象として不適格であったことが判明した場合
- 被験者が来院しなくなった場合
- 研究責任者等が安全確保の点で研究の中止が適切と判断した場合
研究責任者等は研究を中止する旨を当該被験者に速やかに説明し、中止時の調査を行うとともに中止日及び中止理由を記録する。被験者が来院しなくなった場合は電話等で可能な限り追跡調査し、有害事象の有無等を調査する。
なお本研究自体が中止となった場合は、参加施設の病院長、倫理委員会に、その旨を報告する。
07 | 併用・支持療法
原疾患の治療は、患者の病状に併せて、主治医が適切に治療を行う。副作用(副反応)が生じた場合は、主治医が適切に対処する。
08 | 後治療
原疾患の治療は、患者の病状、得られた検査結果に併せて、主治医が適切に治療を行う。
09 | 予測される有害事象と緊急時の報告方法
- 予測される有害事象
前処置薬によるイレウス、消化管穿孔。前投薬による血圧低下、呼吸抑制、アレルギー反応
MR enterographyの造影剤によるアレルギー反応
内視鏡検査による穿孔、出血 - 緊急時の報告方法
本研究参加施設にて有害事象が発生した場合には、各施設の担当者は速やかに研究事務局責任者(兵庫医科大学 腸管病態解析学/炎症性腸疾患内科 渡辺憲治)に電話(0798-45-6663)ないしメール(ke-watanabe@hyo-med.ac.jp)にて報告を行うものとする。また研究事務局研究責任者は速やかに兵庫医科大学倫理審査委員会に報告を行う。
10 | 評価項目及びその基準
主要評価項目:MRE+ICS群とMRE+BAE群の回腸終末部を含む小腸活動性粘膜病変有所見率
なお活動性粘膜病変は、MREにおいては潰瘍、内視鏡検査においては潰瘍、びらんと定義する。
副次評価項目
- MRE+ICS群とMRE+BAE群を各所見別に対比
- 疾患活動性、CRP別の2群間の各所見の対比
- 新内視鏡スコアとMaRIAを対比
- 内視鏡スコアとSES-CDを対比(炎症最強部位観察と広範囲観察の妥当性も検討: MREとBAE+選択造影を対比)
- 新内視鏡スコアとHBI, 便中カルプロテクチン
- MaRIAとHBI, 便中カルプロテクチン
- MREとBAEの観察範囲
- 新内視鏡スコアのvalidation: inter/intra observer validation
- SES-CDの問題点も検討:SES-CDで表現できない深部小腸のデータ
- 有害事象
- 検査後3年までの累積再燃率、累積手術率等の長期臨床経過
11 | 解析方法
分割表分析:Chi-square test、Fisher’s exact test
対応のない2群の比較:対応のないt検定、Mann-Whitney U test
対応のある2群の比較:対応のあるt検定、Wilcoxon sign rank test
など
なお、本研究の結果を公表する際には、新内視鏡スコアの配点結果に基づいた解析結果は、非公表、ないし後日の追加検討の結果により配点を変更した解析結果を公表する可能性がある。
12 | 研究予定期間
- 症例集積期間:2018年2月20日 ~ 2021年 12月31日
- 症例追跡期間:2018年2月20日 ~ 2024年 12月31日
13 | 研究予定症例数とその設定根拠
下記の算定により132例(各群66例)とする。なお、中間解析を実施し、症例数の増加が必要と判断された場合は、研究参加各施設の倫理委員会承認を得たうえで、必要症例数の追加を行う。
中間解析は症例集積66例の時点で下記のプロトコール委員の協議により行う。(主要)評価項目で有意差を認めれば、症例登録を終了する可能性がある。
- 辻仲病院柏の葉 消化器内科・IBDセンター 竹内 健
- 慶應義塾大学医学部 消化器内科 長沼 誠、細江直樹
- 慶應義塾大学医学部 放射線診断科 奥田茂男、鈴木達也
- 東京医科歯科大学 消化器内科 大塚和朗
- 東京医科歯科大学 放射線科 北詰良雄
- 自治医科大学 消化器内科 矢野智則
- 福岡大学医学部 消化器内科学講座 平井郁仁
- 大船中央病院 放射線科 屋代香絵
- 東邦大学社会医学医療統計学分野 村上義孝
- 兵庫医科大学 腸管病態解析学/炎症性腸疾患学内科部門 渡辺憲治
本研究に先立って行われた前相のProgress Study (feasibility study)の結果から、CRP0.3未満の症例における粘膜活動性病変有所見率は、MREによる小腸病変が16.7%、ICSで内視鏡観察不可部位のBAEによる小腸病変が40.0%であった。これからBAEの有所見率を40%、MREの有所見率を15%とし、αエラー5%、βエラー20%(検出力80%), 1:1の割り付けとして必要症例数を計算したところ、一群49人、二群合計98人となった。上記研究より回腸中部未到達35%とすると、98例×1.35≒132例が必要とされる。
14 | 資料・薬剤・用具の保管場所及び責任者
内視鏡動画および写真:
(保管場所)兵庫医科大学 炎症性腸疾患内科 医局
(保管責任者)兵庫医科大学 炎症性腸疾患内科 特任准教授 渡辺憲治
本研究に関する資料は本研究の終了および結果の論文化終了まで各施設および兵庫医科大学にて保管される。
15 | 研究責任者・実施分担者
研究責任者:兵庫医科大学 腸管病態解析学/炎症性腸疾患内科 特任准教授 渡辺憲治
兵庫医科大学 炎症性腸疾患学 内科部門 教授 中村志郎, 准教授 樋田信幸, 講師 宮嵜孝子, 助教 上小鶴孝二, 助教 横山陽子, 助教 河合幹夫, 特任助教(腸管病態解析学)佐藤寿行, 病院助手 小柴良司, 病院助手 藤本晃士, 病院助手 小島健太郎, 実験補助 長瀬和子(2019年7月26日現在)
共同研究機関
- 辻仲病院柏の葉 消化器内科・IBDセンター 竹内 健
- 慶應義塾大学医学部 消化器内科 長沼 誠、細江直樹
- 慶應義塾大学医学部 放射線診断科 奥田茂男、鈴木達也
- 東京医科歯科大学 消化器内科 大塚和朗
- 東京医科歯科大学 放射線科 北詰良雄
- 自治医科大学 消化器内科 矢野智則
- 福岡大学医学部 消化器内科学講座 平井郁仁
- 大船中央病院 放射線科 屋代香絵
研究協力機関
- 福岡大学筑紫病院 消化器内科・炎症性腸疾患(IBD)センター 高津典孝
- 弘前大学医学部 消化器・血液内科学講座:櫻庭裕丈
- 国立病院機構 弘前病院 臨床研究部:石黒 陽
- 埼玉医科大学総合医療センター 消化器肝臓内科:加藤真吾
- 滋賀医科大学 消化器内科:安藤 朗、馬場重樹
- 藤田保健衛生大学 消化管内科:大宮直木、長坂光夫
- 札幌東徳洲会病院 IBDセンター:前本篤男
- 防衛医科大学校 消化器内科:穂苅量太、渡辺知佳子
- 大船中央病院 消化器・IBDセンター:遠藤 豊、吉田篤史
医療統計専門家
- 東邦大学社会医学医療統計学分野 村上義孝
モニタリング委員
- 兵庫医科大学病院 メディカルアシスタント(炎症性腸疾患内科) 東 由里
監査委員
- 内科・胃腸内科 むらのクリニック 村野実之
16 | 監査について
- 実施時期
試験開始後6か月毎に施行する。 - 実施担当者(複数選択可)
本研究と関係のない研究グループ外である、監査委員(内科・胃腸内科 むらのクリニック)村野実之 - 実施内容
- 研究の進捗状況:同意取得者数、被験者数(症例登録数)、中止・脱落例数およびその理由の確認
- インフォームド・コンセント(IC):各施設において同意取得に問題がないかを各施設の責任医師に確認
- 安全性情報:有害事象(AE)、重篤有害事象(SAE)の発生状況の確認。SAE発生時の事後対応の確認(機関の長への報告、当局報告、研究中断・中止基準への抵触など)
- 研究情報の確認(学会発表などの有無、内容)。措置情報の確認(試験薬の添付文書改訂、当局からの注意喚起文書などの有無、内容)
- 研究データの信頼性について:症例登録・割付手順の的確性の確認
- 諸規則等および研究計画の遵守:研究参加施設の倫理審査承認に関する確認(許可通知書の保管など)。臨床試験登録に関する確認(UMIN臨床試験登録など:完了状況、内容更新の有無・要否など)。諸規則等の全般的遵守状況(倫理指針、臨床研究法など)
17 | 各参加施設におけるモニタリングについて
モニタリング委員は、研究計画書に沿った症例登録、各検査が遂行されているか、登録割付例が66例に達した時点で確認する。本研究の科学的信頼性または被験者の安全性に影響を与える可能性がある重大な問題事項があった場合、モニターは、研究責任者及び必要に応じて研究代表者に連絡するとともに、是正策・予防策を講じる。
V. 研究における医学倫理的配慮について
研究の安全性に対する配慮の方法
研究責任医師等は、被験者の登録に際して選択基準、除外基準を遵守し、事前検査、問診により適格性を判定し、安全性を確保できない被験者は登録しないようにする。被験者に説明し同意を得る方法
倫理審査委員会で承認の得られた同意説明文書を渡し、口頭および文書により十分な説明を行い、文書にて同意を得る。なお、当試験への参加が任意であること、参加に同意しない場合でも不利益を受けないこと、当試験で得た同意について、いつでも不利益を受けることなく撤回する権利を有することを説明文書に記載の上保証する。患者が未成年の場合には本人に加え患者の親権者等の代諾者にも患者と同様に本研究の説明を行い、代諾者の同意取得を行う。研究対象となる個人の人権の擁護方法
本臨床研究はヘルシンキ宣言(世界医師会)、人を対象とする医学系研究に関する倫理指針(厚生労働省)、個人情報保護法を遵守して施行される。担当医師は、本試験の実施にあたっては倫理的な配慮を慎重にし、試験内容について十分説明した上で、本申請書に添付する文書で、患者本人の同意を得る。研究に参加するか否かは、被験者本人の自由意思により決定され、同意後であっても、被験者本人の意思によりいつでも中止が可能である。また、参加中止に伴う不利益は受けない。本研究で知り得た情報は、個人が同定できる形ではいかなる状況においても公表せず、かつ厳重な管理下で保管される。また、本人が希望すれば、本人の情報は本人にのみ文書にて報告する。試験の費用負担
本研究における諸検査および前処置薬、前投薬の費用は、MR enterographyとバルーン小腸内視鏡が同日に行われた場合を含め、通常の保険診療にて行われる。特定疾患医療費補助を受けておられる患者さんにおいては、月額自己負担額範囲内の負担になる。
なお、本研究は公益財団法人内視鏡医学研究振興財団の多施設共同研究助成を受けている。便中カルプロテクチンの測定に関わる費用はサーモフィッシャーダイアグノスティックス株式会社で全額負担を行なうとの契約により測定され、被験者や研究参加施設に費用負担は生じない。健康被害に対する補償
もし、試験期間中あるいは終了後に被験者に施行した検査或いは使用した薬剤によると思われる副作用などの健康被害が生じた場合には、担当医師が保険診療の範囲内で適切な診察と治療を行う。なお、本試験は別途臨床研究保険へ加入する。研究成果の帰属と結果の公表
本調査研究の成果は、研究参加施設および厚生労働省難治性炎症性腸管障害班会議(班長:鈴木康夫 東邦大学医療センター佐倉病院IBDセンター センター長)に帰属する。
本研究はUMIN登録されている(UMIN000031261)。研究成果は、研究対象者の氏名等、個人情報が明らかにならないようにして、学会発表や学術雑誌等で公に発表することがある。研究者の利益相反状態についての申告
本研究の研究責任者および実施分担者における利益相反状態については、兵庫医科大学利益相反委員会の審査結果に基づき、必要な措置を講じた上で研究を実施する。倫理審査委員会の承認
本研究は兵庫医科大学倫理審査委員会の承認を得て実施する。記録・試料の作成、提出、保管、廃棄
- 提出:本試験では,インターネットを介したElectronic Data Capture (EDC) システムを用いて,浜松医科大学臨床研究管理センターのデータセンターがデータ収集を行う.試験実施医療機関の試験責任医師および実施分担医師は,本試験への参加にあたりEDCシステム利用者登録を行った後に、EDC入力を行う。
匿名化した内視鏡動画および写真は研究責任者に送付する。便中カルプロテクチン測定のための便検体は、別途契約内容に則り、サーモフィッシャーダイアグノスティックス株式会社に送付され、測定される。記録・試料を送付する際は「様式1)他の研究機関への試料・情報の提供に関する記録」を作成し添付する。 - 保管:研究責任者が各参加施設から送付された匿名化された内視鏡動画および写真、他の研究機関への試料・情報の提供に関する記録を保管することで、各参加施設における記録の保管の義務を代行する。ただし各参加施設の責任者は取得した同意文書、被験者識別コードと患者との対応表を研究終了後原則5年間保管する(ただし各施設の規定に従う)。研究責任者は兵庫医科大学の規定に従い、試料・記録類を適切に保管する。具体的には、記録類は可能な限り電子化し研究責任者が責任をもってハードティスク等の記憶媒体で当該研究の結果の公表から10年間保管し、保管期間終了後は、個人を識別できる情報を取り除いた上で廃棄(消去)する。便検体は測定まで臨床研究実施機関およびサーモフィッシャーダイアグノスティックス株式会社において冷凍(約-20℃、超低温フリーザーは避ける)で保存する。
- 廃棄:本研究において得られた記録・試料を廃棄する際は、匿名化したまま個人情報が含まれていないか確認した上で廃棄する。サーモフィッシャーダイアグノスティックス株式会社で測定された後の残余便検体は、サーモフィッシャーダイアグノスティックス株式会社で研究終了後1ヶ月以内に破棄される。
- 提出:本試験では,インターネットを介したElectronic Data Capture (EDC) システムを用いて,浜松医科大学臨床研究管理センターのデータセンターがデータ収集を行う.試験実施医療機関の試験責任医師および実施分担医師は,本試験への参加にあたりEDCシステム利用者登録を行った後に、EDC入力を行う。
研究対象者に生じる負担並びに予測されるリスク及び利益、これらの総合的評価並びに当該負担及びリスクを最小化する対策
本研究は保険診療の範囲内で行われるが、検査施行の時期については、研究対象者の臨床経過で意義ある時期を担当医師が選択して、研究対象者に依頼する。検査施行に当たっては研究参加施設の責任医師、分担医師が有害事象の発生リスクおよび研究対象者の負担を最小化するよう総合的に評価し、各施設の状況に応じて、検査施行方法を適宜配慮する。本研究で施行する採血は、本研究参加のために行うのではなく、通常診療で必要性があった時に施行されるものを用い、便検体の提出のために余分な来院を要しないように配慮する。
VI. 文献
08 | 効果・安全性
- 3rd European Evidence-based Consensus on the Diagnosis and Management of Crohn's Disease 2016: Part 1: Diagnosis and Medical Management. J Crohns Colitis. 2017; 11:3-25.
- 渡辺憲治ら、クローン病 MR enterography (MRE)アトラス、厚生労働科学研究費 難治性疾患等政策研究事業「難治性炎症性腸管障害に関する調査研究」(鈴木班)、2017
インフォメーション
- 2020.04.09チーム情報を公開しました

